Silvester naht und damit die unkontrollierte Detonation gefährlicher Sprengstoffe. Aber sie leuchten bunt und knallen laut, deshalb ist uns das für diese eine Nacht im Jahr egal. Wie aber kommen die Farben ins Feuerwerk? Tatsächlich versteckt sich auch in etwas so Alltäglichem, Riesigem wie einem Feuerwerk Quantenphysik.
19 shapes of ice
Beginnen wir ganz grundlegend: mit dem Feuer. Ich wundere mich tatsächlich nicht, dass Menschen im antiken Griechenland und noch über das Mittelalter hinaus an die Vier-Elementen-Lehre glaubten. Alles bestehe es aus den vier Grundelementen: Erde, Wasser, Luft und Feuer.
Sie stehen für verschiedene Phasen von Materie: das Feste, das Flüssige, das Gasförmige und – offensichtlich – das Glühende. Im Prinzip ist das gar nicht mal so dumm, denn etwas ganz Ähnliches kennen wir von vielen (chemischen) Elementen, wie etwa von Wasser. Das kann flüssig, fest und gasförmig sein kann. Brennen tut Wasser jedoch eher selten.

Wir wissen heute, dass Materie aus Molekülen aufgebaut ist und die wiederum aus Atomen. Je nachdem wie sich die Atome anordnen, ist der Stoff, vereinfacht gesagt, fest, flüssig oder gasförmig. Vereinfacht ist das, weil viele Stoffe mehr als diese drei Aggregatzustände annehmen können. Tatsächlich kann Eis 19 bekannte Phasen annehmen. Abhängig vom Druck und der Temperatur ordnen sich die Moleküle in verschiedenen Geometrien an.
Der Stoff, der brennt
Doch was ist eigentlich Feuer? Besteht es auch aus Atomen? Im 17. Jahrhundert glaubten die Menschen, allen brennenden Stoffen entweiche ein mystischer Stoff, eine flüchtige Substanz, die in Form einer Flamme verbrennt. Diese nannten sie Phlogiston, vom griechischen Wort für „verbrannt“.
Vor allem basierte das auf der Beobachtung, dass viele Stoffe leichter werden, wenn sie verbrennen, zum Beispiel Holz oder Papier. Andere Stoffe wurden aber schwerer, was nicht ganz ins Bild passte. Aber das störte niemanden allzu sehr, Chemie war damals kaum mehr als fortgeschrittene Alchemie.

Der deutsch-schwedische Apotheker und Chemiker Carl Wilhelm Scheele wollte es genauer wissen. Er zündelte 1772 mit verschiedenen Stoffen herum und versuchte, Phlogiston herzustellen. Er erhitzte verschiedene Stoffe in Schwefelsäure und entdeckte ein farb- und geruchsloses Gas, das er anzünden konnte. Das nannte er: Feuerluft.
Der englische Chemiker und Theologe Joseph Priestley führte etwas später ähnliche Experimente durch und nannte die „Feuerluft“ von Scheele selbst „phlogistonfreie Luft“. Weil er seine Ergebnisse drei Jahre vor Scheele veröffentlichte, erhielt Priestley den Ruhm für die Entdeckung – dumm gelaufen für Scheele.
Beide wussten aber noch nicht, dass sie ein neues Element entdeckt hatten: Feuerluft kennen wir heute unter dem Namen Sauerstoff. Das entdeckte erst der französische Chemiker Antoine de Lavoisier. Er nahm an, dass das Element Grundbestandteil zur Bildung von Säuren sei (ist es aber nicht, sondern Wasserstoff), sodass das Element 1779 den Namen „Oxygenium“ erhielt, was Säurebildner bedeutet – Sauerstoff.
Was ist Feuer?
Es gibt also keine Feuerluft, aber was genau ist nun Feuer? Wir können es sehen, aber nicht anfassen und es ist sehr heiß. Was für ein Feuer nötig ist, ist ein brennbares Material, zum Beispiel Holz, Sauerstoff und eine ausreichend hohe Temperatur.
Feuer ist das sichtbare Ergebnis einer Verbrennung. Das wiederum ist eine chemische Reaktion, bei der ein brennbarer Stoff mithilfe von Sauerstoff oxidiert und Energie frei wird. Kurz gesagt, ist also Feuer die Energie, die bei einer bestimmten Form der chemischen Reaktion frei wird. Das ist bedeutend abstrakter, als „Materie besteht aus kleinen Kügelchen“ – ich wunder mich nicht, dass Feuer die Menschen früher wie heute so fasziniert.

Feuer ist aber nicht nur heiß, sondern wir können es auch sehen. Eine Flamme bildet sich, weil bei einer Verbrennung Gase freiwerden, diese steigen nach oben – weil sie eine geringere Dichte haben als Luft – und es bildet sich die typische Flammenform. Weil der Dichteunterschied in der Schwerelosigkeit keine Rolle spielt und die Gase nicht nach oben steigen, haben Flammen im Weltraum übrigens keine Tropfenform, sondern sind kugelrund.
Warum können wir Feuer sehen?
Bei einer Verbrennung bleibt aber fast immer etwas übrig und in einem Lagerfeuer oder einer Kerze ist das der Ruß. Dieser besteht aus Kohlenstoff. Diese kleinen Kohlenstoffpartikelchen schweben nach oben und fangen in der Hitze an zu glühen – und das ist es, was wir sehen können. Der Grund, warum sie orange-rötlich glühen, ist die Schwarzkörperstrahlung (mehr dazu hier). Bei einer Flammentemperatur von knapp 1200 bis 1400 Grad hat diese eine orange Farbe.
Das ist jedoch nicht der einzige Grund, warum wir Feuer sehen können. In einem Bunsenbrenner zum Beispiel verbrennt kein Kohlenstoff, sondern Propan oder Butan – Gase, die aus Kohlenstoff-Wasserstoffketten bestehen, also aneinandergereihte Kohlenstoff- (C) und Wasserstoffatome (H). Bei „geringer“ Hitze von etwa 900 Grad ist die Verbrennung unvollständig und die entstehenden Rußteilchen leuchten.
Bei voller Hitze von ca. 1500° Grad ist die Flamme jedoch rauschend und blau. Diese Flamme heißt nicht-leuchtend, weil das Gas vollständig verbrannt wird und nicht etwa Rußteilchen leuchten. Die Kohlenstoff-Wasserstoff-Ketten brechen in der Hitze auf. In dem Grund, warum diese CH-Verbindungen blau leuchten, versteckt sich endlich die Quantenphysik!
Ein bunter Quantensprung
Atome bestehen aus Protonen, Neutronen und Elektronen und – wie wir bereits wissen – können Elektronen nur auf ganz bestimmten Bahnen um den Atomkern kreisen. Sie können nicht zwischen zwei Bahnen fliegen, sondern nur von einer Bahn zur nächsten hüpfen. Um auf eine höhere Bahn zu hüpfen, brauchen sie Energie – zum Beispiel die, die bei einer Verbrennung frei wird.

Auf den höheren Bahnen gefällt es den Elektronen aber nicht sehr gut und irgendwann hüpfen sie zurück auf eine niedrigere Bahn. Dabei wird eine ganz bestimmte Menge Energie frei, sie ist charakteristisch für das Atom. Die Energie wird in Form von Paketen – Photonen – freigegeben und je nach Menge der Energie, leuchten sie in anderen Farben. Große Energiepakete sind „blauer“ während kleinere „roter“ sind.
Warum ist Feuerwerk bunt?
Das CH-Molekül spuckt Licht mit einer Wellenlänge von 432 Nanometern aus, also blaues Licht, wie wir es im Bunsenbrenner sehen können. In anderen Elementen sind die Abstände zwischen den Bahnen anders und die Flamme leuchtet in einer anderen Farbe.
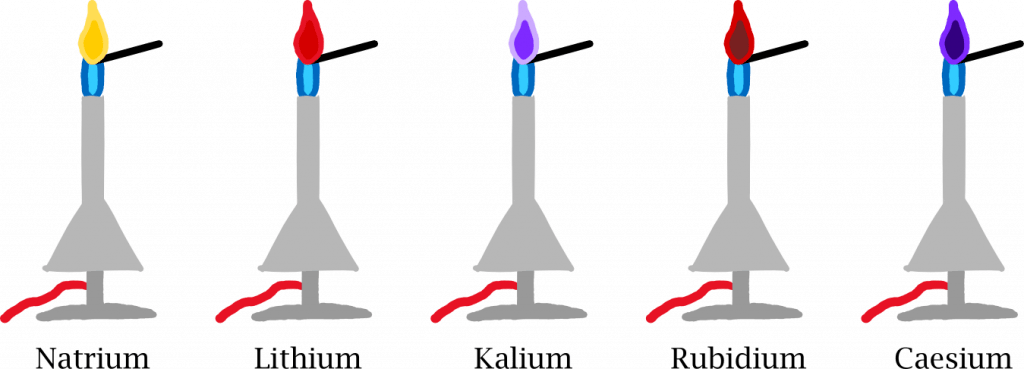
Das Element Rubidium verbrennt rot, Caesium blauviolett. Chemiker:innen nutzen das, um Elemente zu identifizieren. Pyrotechniker:innen, um buntes Feuerwerk zu erzeugen. Mischen sie Kupfer in den Sprengkörper, bekommen sie smaragdgrüne Explosionen, Kochsalz färbt sie gelb, Kalium violett und Strontium rot.

Wenn ihr das nächste Mal ein Feuerwerk seht, könnt ihr also versuchen, die Elemente zu erraten und dabei an die hüpfenden Elektronen denken, denen bei jedem Feuerwerk ordentlich Feuer unterm Hintern gemacht wird.
Gefällt dir, was du liest? Dann kannst du mir hier einen Kaffee spendieren! Und wenn du keinen neuen Beitrag mehr verpassen willst, vergiss nicht meinen Blog zu abonnieren.
