Auch Wissenschaftler:innen sind nur Menschen. Deshalb lesen sich Erfolgsgeschichten nicht selten wie ein Comicbuch: große Helden im Kampf für das Gute zum Wohle der Menschheit. Aus einem anderen Blickwinkel wirkt es aber manchmal eher wie das Gezeter alter, weißer Männer, die darum streiten, wer Recht hat. Beispiele dafür haben wir schon einige gesehen: Boltzmann und Planck im Kampf um die Entropie, Thomson und Rutherford bei der Entschlüsselung des Atoms, Newton und der Rest der Welt bei der Natur des Lichts. Und auch das Stern-Gerlach-Experiment, das diesen Monat seinen hundertsten Geburtstag feierte und zu den Meilensteinen der Quantenphysik gehört, war die Erfindung eines Wissenschaftlers, der unbedingt Recht haben wollte.
Das Stern-Gerlach-Experiment wurde in der Nacht vom 07. auf den 08. Februar 1922 von Otto Stern und Walter Gerlach in Frankfurt durchgeführt. Otto Stern war ein jüdisch-stämmiger, theoretischer Physiker und Hirn des Experiments, der – wie so viele Wissenschaftler – Deutschland 1933 verließ. Walther Gerlach war Experimentalphysiker, der „Macher“ des Experiments, und war… nun, wenn auch kein Nazi, so doch zumindest dem Nazi-Regime als „Reichsmarschall für Kernphysik“ dienlich. Dies hat vermutlich dazu beigetragen, dass das Otto-Stern-Zentrum der Goethe Universität Frankfurt nur einen der beiden Wissenschaftler ehrt. Vielleicht war es aber auch, weil Stern 1943 alleiniger Nobelpreisträger für Physik wurde – ohne Gerlach.
Wir sehen hier bereits erste Ansätze menschlichen Dramas, doch bei der angekündigten Zankerei ging es nicht um Meinungsverschiedenheiten zwischen Stern und Gerlach. Am Anfang des berühmten Stern-Gerlach-Experiments stand Stern, der Bohrs und Sommerfelds Atommodell für Unsinn hielt.
Das Bohrsche Atommodell
Es ist 1913 und über die Struktur von Atomen – den Grundbausteinen der Materie – ist noch verblüffend wenig bekannt (einen Überblick über frühere Atommodelle findet ihr hier). Nur wenige Jahre zuvor hatte Ernest Rutherford sein Atommodel mit seinem historischen Rutherfordschen Streuversuch untermauert: das Atom setzt sich aus einem positiv geladenen Kern und drumherum schwirrenden, negativ geladenen Elektronen zusammen.
Wer sich ein kleines bisschen mit klassischer Elektrodynamik auskennt weiß: das ist doch Unsinn! Positive und negative Ladungen ziehen sich an! Ein so aufgebautes Atom wäre höchst instabil. Das Elektron müsste in den Kern schlingern und dabei Strahlung mit kleiner werdender Frequenz emittieren. Das passt aber nicht, denn man wusste bereits, dass Atome nur Licht ganz bestimmter Frequenzen emittieren oder absorbieren.
Niels Bohr nahm sich dieses Problems auf eine sehr wunderliche Weise an. Er stellte drei Postulate auf, die das Fundament für sein neues Atommodell sind. Postulate – das sind kühne Behauptungen, die „noch zu beweisen sind“. Wichtigste (wenn auch nicht explizit ausgesprochene) Annahme Bohrs: Zum Teufel mit klassischer Mechanik und Elektrodynamik! Ich mach hier mein Ding! Schauen wir uns diese drei Postulate jedoch etwas genauer an.
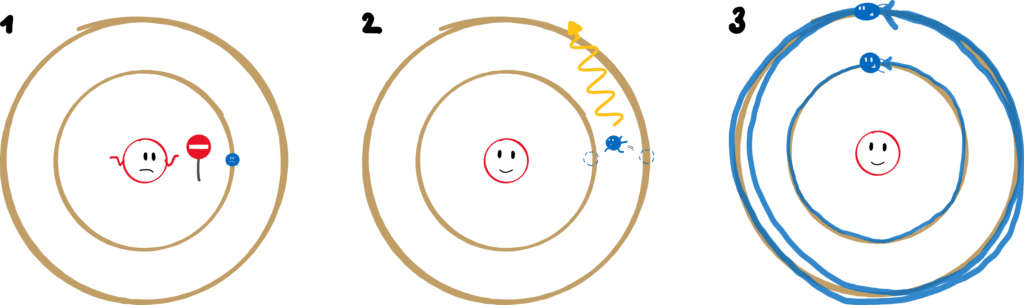
1. Ein Elektron darf sich nur auf bestimmten Bahnen bewegen. Auf diesen bewegt es sich aber strahlungsfrei.
Nur bestimmte Bahnen sind erlaubt? Das widerspricht der klassischen Mechanik: Planeten können sich prinzipiell auf beliebigen (elliptischen) Bahnen um die Sonne bewegen. Elektronen sind nur ganz bestimmte Bahnen erlaubt – der Raum dazwischen ist tabu. Und darauf bewegen sie sich strahlungsfrei? Das hatten wir schon, das widerspricht der klassischen Elektrodynamik!
2. Ein Elektron kann von einer Bahn auf eine andere hüpfen (Quantensprung). Hierbei muss es genau die passende Energie aufnehmen oder abgeben.
Okay, wenn man Postulat 1 akzeptiert, ergibt Postulat 2 irgendwie Sinn. Wenn es nur bestimmte, erlaubte Bahnen gibt, dann muss das Elektron von einer zur anderen hüpfen. Das es aber nur dabei Energie aufnimmt oder abgibt – und das in fixen Portionsgrößen – widerspricht ebenfalls der Elektrodynamik. Stell dir vor du könntest nur 1 A(mpere) Strom haben oder 2 A, aber nicht 1,1 A. Absurd.
3. Der Drehimpuls der Elektronen auf den Bahnen ist ein ganzzahliges Vielfaches des Planckschen Wirkungsquantums.
Das klingt etwas technisch, aber bleibt bei mir! Der Drehimpuls beschreibt salopp gesagt mit wieviel „Schwung“ sich etwas dreht. Wenn ein Elektron (bildlich gesprochen) in einer gewissen Zeit genau einmal um die niedrigste Bahn flitzt, dann braucht es genau doppelt so lang, um die nächst höhere Bahn einmal zu umrunden. Dass dieser minimale Drehimpuls genau dem Planckschen Wirkungsquantum entspricht ist schon sehr elegant und war von Bohr eigentlich nur geraten. Oder anders gesagt: genau dieser Wert ermöglichte es, mithilfe von Bohrs Atommodell experimentelle Beobachtungen zu erklären. So abenteuerlich Bohrs Atommodell auch klingt, es war in der Lage sehr viele Phänomene zu erklären und konkrete Vorhersagen zu machen.
Das Bohr-Sommerfeldsche Atommodell
Der theoretische Physiker Arnold Sommerfeld hat das Bohrsche Atommodell 1916 noch etwas verfeinert. Statt Kreisbahnen nahm er Ellipsenbahnen an, wie man sie vom Sonnensystem schon kennt. Er führte außerdem drei Quantenzahlen ein (nicht nur eine, wie Bohr). Quantenzahlen sind ganze Zahlen (0, 1, 2, …, -1, -2, …) und der Inbegriff der Quantisierung: physikalische Größen liegen nicht mehr irgendwo auf einem Zahlenstrahl, sondern nur noch bei diesen ganzzahligen Schritten.
Die drei Quantenzahlen von Sommerfeld quantisieren die Energie, den Drehimpuls und die Orientierung der Ellipsenbahn. Lasst mich das wiederholen: die ORIENTIERUNG der Bahnen! Es gibt nicht nur eine Einschränkung, welche Bahnen ein Elektron nehmen darf (wie Bohr bereits behauptete), sondern auch, wie diese im Raum orientiert sein dürfen. Stellt euch vor, bei einem Kettenkarussell könnten die Körbe nur vertikal nach unten, nach oben, oder 90° zur Seite zeigen, aber nicht dazwischen! Dieses Phänomen heißt Richtungsquantisierung und konnte das Verhalten von Atomen in Magnetfeldern erklären.
Als Randbemerkung: Wenn man mit heutigen Augen drauf schaut, ist es extrem faszinierend, wie gut diese Herren geraten haben. Denn wenn man das Wasserstoff-Atom einmal mit ordentlicher Quantenmechanik durchrechnet, bekommt man (fast) die gleichen Quantenzahlen dabei heraus. Aber wartets ab, das war noch nicht der erste Glückstreffer, den wir heute sehen werden.
Stern ist unzufrieden
Otto Stern hat sich sehr an diesem Atommodell gestört. Wegen der Verletzung der Mechanik und Elektrodynamik, die seit Jahrhunderten bestehen? Nein. Wegen der Richtungsquantisierung der Elektronenbahnen. Er wollte diesem Unfug ein Ende bereiten und sich ein Experiment überlegen, das die Richtungsquantisierung widerlegt.
Gesagt, getan. Er brauchte Mitstreiter: Walther Gerlach, der fit im Experimentieren war, aber auch Max Born und den Mechaniker Adolf Schmidt. Und sie brauchten eine Menge Spendengelder, um das Experiment aufbauen zu können, und die kamen unter anderem von Albert Einstein und diversen Firmen. Im Februar 1922 war es dann so weit.
Mini-Magnete im Magnetfeld
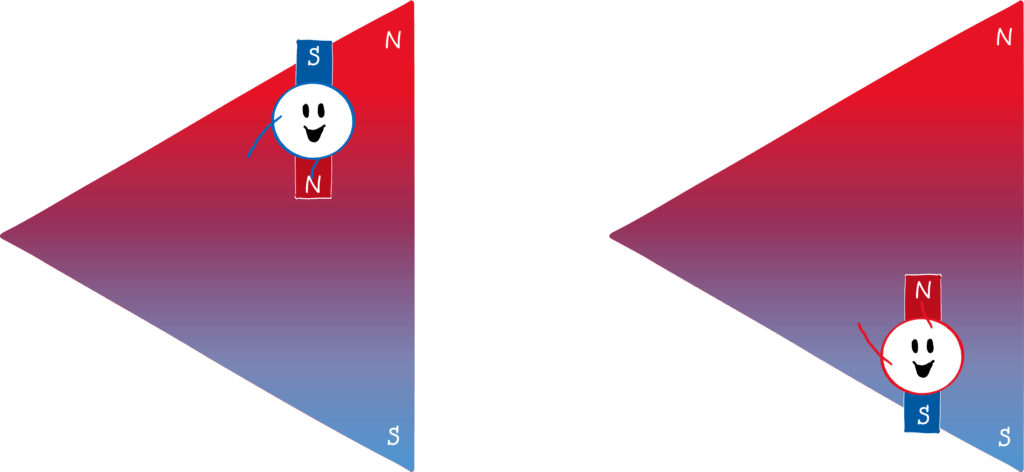
Um die Richtungsquantelung nachzuweisen (oder zu widerlegen) haben Stern und Gerlach ein bekanntes Gesetz der Elektrodynamik ausgenutzt. Es bezieht sich auf das Verhalten magnetischer Dipole – also quasi elementarer Mini-Magnete – in einem Magnetfeld. Das Prinzip eines Kompasses ist, dass sich die Nadel (ein Mini-Magnet) in einem äußeren Magnetfeld (dem Erdmagnetfeld) ausrichtet. Die Nadel dreht sich allerdings nur: würde man den Kompass auf ein kleines Wägelchen bauen, würde es nicht zum Nordpol fahren. Das ist jedoch anders in einem inhomogenen, also einem ungleichmäßigen, Magnetfeld. Wäre des Magnetfeld am Nordpol der Erde zum Beispiel viel stärker als am Südpol (zum Beispiel wenn die Erde keine Kugel, sondern ein Eiscreme-Waffelhörnchen mit der Spitze nach oben wäre), würde das Kompass-Wägelchen zum Nordpol fahren!
Warum ist das so? Zeichnen wir den Nordpol rot und den Südpol blau (siehe das Bild unten). Da der Nordpol stärker ist, ist der obere Teil des Magnetfeldes „roter“ als der untere Teil blau. Wenn nun ein Mini-Magnet (also ein magnetischer Dipol) durch dieses Feld flitzt und sein Südpol nach oben zeigt (links), dann wird er nach oben abgelenkt. Grund dafür ist, dass sich Nord- und Südpol von Magneten anziehen. Weil das Magnetfeld oben stärker ist als unten, zieht der rote Teil des Feldes den blauen Teil des Magneten stärker an als der blaue Teil des Feldes den roten Teil des Magneten. Umgekehrt ist es, wenn der Nordpol des Mini-Magneten nach oben zeigt (rechts). Dann stößt der rote Teil des Feldes den roten Teil des Magneten stärker ab, als der blaue Teil des Feldes den blauen Teil des Magneten abstößt.
Das Stern-Gerlach-Experiment
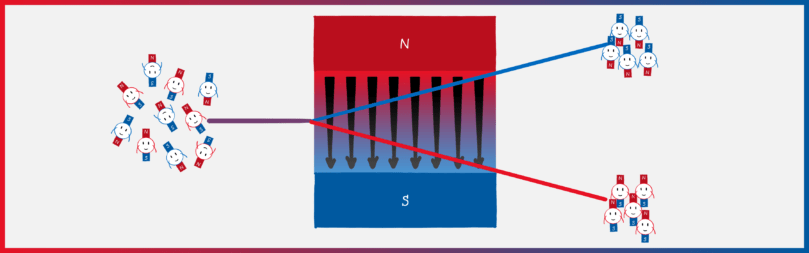
Der Clou des Stern-Gerlach-Experiments ist, dass sich Atome wie Mini-Magnete verhalten. Ganz klassisch würde man erwarten, dass die Mini-Magnete im Atom in jede beliebige Richtung zeigen können. Schießt man Atome durch ein inhomogenes Magnetfeld müsste auf der gegenüberliegenden Seite also ein verschmierter Streifen zu sehen sein.
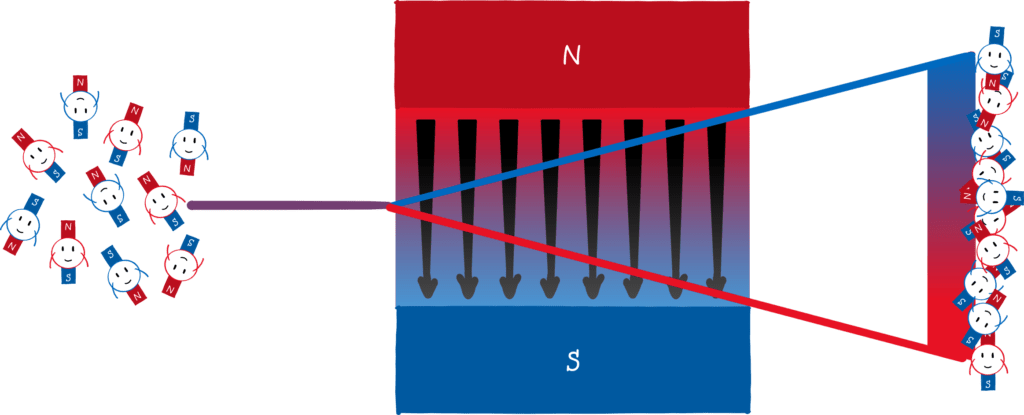
Laut dem Bohr-Sommerfeldschen Atommodel ist die Richtung der Bahnen, und damit die Richtung der Mini-Magnete, aber gequantelt! Statt einer Schliere müsste man also zwei (oder mehr) Punkte auf dem Schirm sehen.
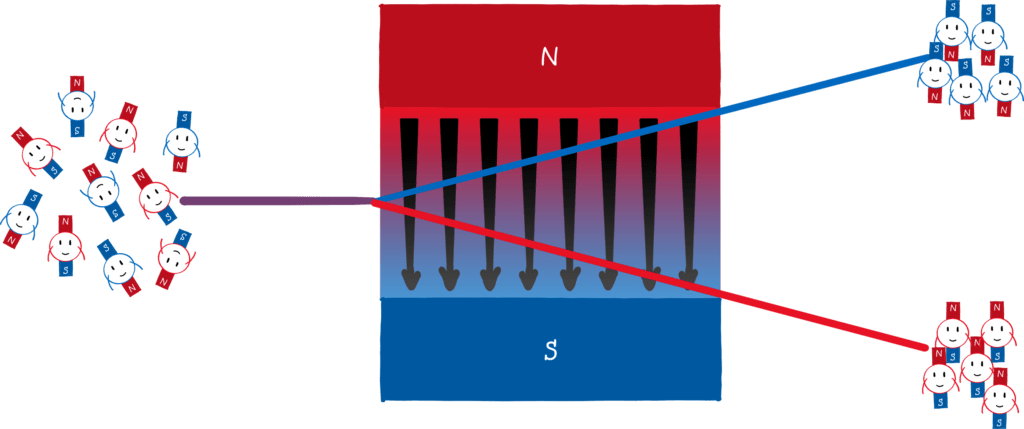
Genau das haben Stern und Gerlach in ihrem Experiment mit Silber-Atomen gemacht und was kam raus? Trommelwirbel! Zwei Punkte! Stern hatte sich so gefreut, dass er fast vergessen hat, dass er ursprünglich gegen die Richtungsquantelung war. Er schrieb ein aufgeregtes Telegramm an Gerlach mit der Nachricht „Bohr hat doch Recht!“. Stern ist ein vorbildlicher Verlierer. Er wollte Bohr widerlegen und hat sein Atommodell letztendlich untermauert.
Der Schein trügt
Ein kleines Detail stimmt jedoch noch nicht. Man fand später heraus, dass das äußerste Elektron von Silber einen Drehimpuls von Null hatte. Einen Drehimpuls von Null kann man nicht in der Richtung „quanteln“ – er ist immer Null. Stern und Gerlach nahmen ursprünglich an, der Drehimpuls wäre 1, damit hätte er nach oben (1), unten (-1) oder in die Mitte (0) zeigen können. Dass man aber zwei, und nicht die erwarteten drei, Punkte im Experiment gesehen hatte, störte scheinbar niemanden so richtig. Aber mit einem Drehimpuls von 0 gibt es keine Mini-Magneten. Man dürfte also gar keine Ablenkung der Atome beobachten. Die Auflösung folge erst drei Jahre später.

Der Drehimpuls des Elektrons auf seiner Bahn um den Atomkern ist nicht der einzige, der im Atom eine Rolle spielt. Auch das Elektron selbst dreht sich – zumindest metaphorisch gesprochen. Das Elektron hat einen Spin, den wir uns gern als Eigendrehimpuls vorstellen. Aufgrund dieser Drehung um sich selbst hat das Elektron ein magnetisches Moment und verhält sich wie ein Mini-Magnet. Und dieser Drehimpuls hat den Wert: 1/2! Damit kann er entweder nach oben (+1/2) oder nach unten (-1/2) zeigen und genau daher kommen die zwei Punkte im Experiment.
Letztendlich zeigten Stern und Gerlach also nicht die Richtungsquantelung der Bahndrehimpulse von Atomen, sondern die Richtungsquantelung des Elektronenspins – etwas völlig anderes. Sie hatten also absolutes Glück, dass das Experiment überhaupt ein Ergebnis zeigte, das so ähnlich zu dem war, was sie erwarteten.
Ob Glückstreffer oder nicht – das Stern-Gerlach-Experiment hat Geschichte geschrieben. Preise und Gebäude wurden nach diesen Herren benannt. Die prinzipielle Idee hinter dem Experiment, also der experimentelle Aufbau, wird noch heute in weiterentwickelter Form für viele Technologien benutzt. Darunter sind die Kernspinresonanz (NMR) und die Magnetresonanztomographie (MRT), denen ich bereits eigene Artikel gewidmet habe. Was lernen wir daraus? Manchmal ist alles was man braucht eine ordentliche Portion Glück und ein bisschen kindlicher Trotz, irgendwas gutes wird schon dabei herauskommen!
Gefällt dir was du liest? Dann kannst du mir hier einen Kaffee spendieren! Und wenn du keinen neuen Beitrag mehr verpassen willst, vergiss nicht meinen Blog zu abonnieren.